Grundkenntnisse zur Kerntechnik:
Es gibt 92 verschiedene Arten von Atomen (auch „chemische Elemente“ oder „Grundstoffe“ genannt).
Die gesamte Materie baut sich aus 92 Arten von extrem kleinen Teilchen, den Atomen, auf. Jede Art hat ihre speziellen Eigenschaften. In der Regel sind Atome chemisch zu Molekülen verbunden (chemische Verbindungen). So besteht z. B. das Wassermolekül aus zwei Wasserstoffatomen (2 H-Atome) und aus einem Sauerstoffatom (1 O-Atom). Man nennt daher das Wasser eine chemische Verbindung mit der chemischen Formel H2O.
So wie man aus den 26 Buchstaben unseres Alphabets unendlich viele verschieden Wörter bilden kann, so bildeten bzw. bilden die unbelebte und die belebte Natur aus den 92 Atomarten eine Unzahl von chemischen Verbindungen. Manche Moleküle bestehen aus tausenden von gleichen und verschiedenen Atomen. Häufig verbinden sich verschiedene Moleküle zu noch größeren Molekülen. So sind z. B. Eiweißmoleküle recht komplizierte Verbindungen. Obwohl diese Moleküle aus vielen Atomen bestehen, sind sie dennoch sehr klein.
Moleküle kann man auch künstlich herstellen (Kunststoffe).
Ein Atom besteht aus Atomkern und Elektronenhülle.
Der Atomkern setzt sich aus Protonen (positiv geladene Teilchen) und Neutronen (neutrale = ungeladene Teilchen) zusammen. Die Zahl der Protonen im Kern ist entscheidend für die Eigenschaften des Atoms. Ein Wasserstoffatom hat im Kern 1 Proton. Dem Wasserstoff wird daher die Ordnungszahl 1 (OZ 1) zugeordnet. Der Kern vom Kohlenstoffatom enthält 6 Protonen (OZ 6), der vom Sauerstoffatom 8 (OZ 8), der vom Eisenatom 26 (OZ 26) und der vom Jod 53 (OZ 53).
Das größte aller Atome, das Uranatom, enthält in seinem Kern 92 Protonen. Das chemische Element Uran wird daher mit der Ordnungszahl 92 gekennzeichnet. „Das größte aller Atome“ heißt nicht, dass es groß ist. Nein! Es ist unvorstellbar klein.
Die Teilchen der Elektronenhülle, die Elektronen, sind negativ geladene Teilchen, die sich wie Planeten um den Atomkern bewegen und gleichsam eine bewegte Hülle bilden. Die Zahl der Elektronen in der Hülle ist gleich der Protonenzahl im Atomkern.
Alle chemischen Vorgänge sind Vorgänge der Elektronenhülle.
Es gibt auch Atomarten, die in der Natur nicht vorkommen, also künstliche Atomarten – z. B. Plutonium. Bei diesen Arten sind die Atome größer als die Uranatome.
Das Wort „Atom“ geriet durch die Entdeckung der Kernspaltung und der Kernfusion, durch die Atombombenabwürfe im Jahr 1945 und durch die Unfälle in Atomkraftwerken in Verruf.
Nuklide – der Sammelname für alle Atomarten
Alle Atomarten in all ihren Erscheinungsformen werden zusammen mit dem Sammelnamen „Nuklide“ bezeichnet (lat. nucleus = Kern).
Ein Nuklid ist eine Atomart, die durch den Aufbau des Atomkerns, also durch die Anzahl der positiv geladenen Protonen und der ungeladenen Neutronen definiert wird. Von der Protonenzahl hängt es ab, um welches chemisches Element (Grundstoff) der 92 Elementarten es sich handelt, ob um Wasserstoff, Kohlenstoff, Schwefel, Kupfer, Eisen usw.
Nuklide, die die gleiche Protonenzahl haben (gleiche OZ), bilden zusammen die Vielfalt eines chemischen Elements und werden Isotope genannt.
Protonen und Neutronen ergeben zusammen die Massezahl des Atomkerns.
Wenn man alle Isotope der 92 natürlichen Elementarten (die meistens nicht radioaktiv sind) addiert, kommt man auf ca. 280 Nuklide. Dazu kommt die große Zahl von künstlichen Nukliden, die alle radioaktiv sind („radioaktive Nuklide“, "Radionuklide") und in erster Linie in Atomkraftwerken bzw. durch Atombombenexplosionen entstehen.
Isotope – Unterarten von chemischen Elementen
Fast von jedem chemischen Element gibt es mehrere Unterarten, Isotope genannt. Diese Isotope unterscheiden sich durch die verschiedenen Neutronenzahlen. Vom Kohlenstoff (OZ 6) gibt es z. B. 3 Isotope: Kohlenstoff-12 (C-12), Kohlenstoff-13 (C-13) und Kohlenstoff-14 (C- 14). Die Atomkerne aller drei Isotope enthalten je 6 Protonen, jedoch 6 bzw. 7 bzw. 8 Neutronen.
Darstellung einiger Grundstoffe mit ihren Isotopen
|
OZ
|
Chemisches Element (Grundstoff) |
Sym- bol
|
Isotope
|
Protonen im Atomkern
|
Neutronen im Atomkern
|
Anteile am jeweiligen chemischen Element in der Natur (%) |
Halbwerts- zeit (HZ) ***)
"a" = Jahr |
|
1 |
Wasserstoff |
H |
H-1 (Leichtwasserstoff, Protium) H-2 (D-2, Schwerwasserstoff, Deuterium) H-3 *) (T-3, Überschwerer Wasserstoff, Tritium) |
1
1
1 |
0
1
2 |
99,985
0,015
Spuren |
12,3 a |
|
6 |
Kohlenstoff |
C |
C-12 C-13 C-14 *) |
6 6 6 |
6 7 8 |
98,89 1,11 Spuren |
5.730 a |
|
8 |
Sauerstoff |
O |
O-16 O-17 O-18 |
8 8 8 |
8 9 10 |
99,75 0,037 0,204 |
|
|
26 |
Eisen |
Fe |
Fe-54 Fe-56 Fe-57 Fe-58 |
26 26 26 26 |
28 30 31 32 |
5,82 91,66 2,19 0,33 |
|
|
53 |
Jod |
J (I) |
J-127 |
53 |
74 |
100 |
|
|
92 |
Uran |
U |
U-234 *) U-235 *) **) U-238 *) |
92 92 92 |
142 143 146 |
0,0058 0,720 99,274 |
244.000 a 704 Mio. a 4,47 Mrd. a |
*) Radioaktiv:
Unter Radioaktivität versteht man die Tatsache, dass es instabile Atomkerne gibt, die einem oder mehreren Umwandlungsprozessen ausgesetzt sind. Diese Umwandlung geschieht spontan, d. h. ohne äußere Einwirkung bzw. von außen nicht beeinflussbar. Jede Umwandlung hat mit einem Zerfall im Atomkern zu tun („Kernzerfall“). Dabei werden energiereiche Strahlen emittiert. Einerseits können dies weggeschleuderte Teilchen sein („Teilchenstrahlen“), andererseits Quanten von energiereichen elektromagnetischen Wellen, Gamma-Strahlen genannt.
Die natürliche Radioaktivität hat zwei Ursachen: Kosmische Strahlung und Strahlung von bzw. aus der Erde, also aus den oben genannten radioaktiven Stoffen.
Künstliche Radioaktivität wird durch Atombombenexplosionen und durch Atomkraftwerke verursacht, wobei letztere schon bei Normalbetrieb radioaktive Substanzen emittieren. Vor allem droht aber Gefahr von Unfällen in Atomkraftwerken (Tschernobyl, Fukushima…) und vom radioaktiven Müll aus Atomkraftwerken.
**) Spaltbares Uran-Isotop (für die Kernspaltung geeignet)
***) Halbwertszeit:
Das Tempo der Kernumwandlungen in einem instabilen (= radioaktiven) Stoff nimmt mit der Zeit ab, somit auch die Intensität der radioaktiven Strahlung. Obwohl sich bei keinem einzelnen Atom vorhersagen lässt, wann in seinem Kern die Umwandlung stattfinden wird, geschehen diese Umwandlungen in der Gesamtheit der Atome eines radioaktiven Stoffes dennoch nach einer bestimmten Gesetzmäßigkeit, und zwar in der Weise, dass sich die Zahl der Umwandlungen innerhalb einer bestimmten Zeit halbiert. Den Zeitraum bis zur Halbierung der Strahlungsintensität nennt man Halbwertszeit.
Das Tempo der Umwandlung ist je nach Umwandlungseigenschaften der verschiedenen radioaktiven Isotope äußerst unterschiedlich. „Kurzlebige“ radioaktive Isotope wandeln sich rasch um und geben daher ihre Strahlung rasch ab, dafür in enormer Dichte und Schädlichkeit. „Langlebige“ Isotope strahlen lang bis extrem lang, dafür ist ihre Strahlung nicht so dicht und daher auch nicht so schädlich.
So vermindert sich z. B. die Strahlung des Kohlenstoff-Isotops C-14 nach 5.730 Jahren auf die Hälfte. Das heißt, bei der Hälfte der C-14-Atome hat sich die Umwandlung (der Kernzerfall) bereits vollzogen. Innerhalb der weiteren 5.730 Jahre zerfällt die Hälfte von der verbliebenen Hälfte. Somit sind nach 11.460 Jahren 3/4 der Atomkerne bereits zerfallen, 1/4 noch nicht. Die Strahlung hat sich auf 1/4 reduziert. Usw.
Der Zerfall von C-14 vollzieht sich daher mit einer Halbwertszeit (HZ) von 5.730 Jahren. Oder anders ausgedrückt: Die Strahlungsintensität nimmt mit einer HZ von 5.730 Jahren ab.
HZ 5.730 Jahre vom C-14 heißt weiters, dass sich innerhalb von 5.730 Jahren die halbe Menge vom instabilen Kohlenstoff-Isotop C-14 in das stabile Stickstoff-Isotop N-14 umwandelt.
Spaltbare Atome:
Uran-Isotop U-235
Plutonium-Isotope Pu- 239 (und Pu-241)
Uran-Anreicherung:
Uran und seine chemischen Verbindungen sind sehr giftig und außerdem radioaktiv. Wie in der obigen Tabelle gezeigt wird, besteht Natururan aus den drei Isotopen U-234, U-235 und U-238. Praktische Bedeutung haben nur U-235 und U-238, denn das Uranisotop U-234 findet sich im Natururan nur in Spuren. U-238 ist mit 99,3 % der Hauptbestandteil des Natururans, während das spaltbare U-235 nur zu 0,7 % darin enthalten ist. Für die kontrollierte Kernspaltung in Atomkraftwerken kann das Uran nur dann verwendet werden, wenn das Verhältnis zwischen U-238 und U-235 zugunsten von U-235 geändert wird: Der Gehalt von U-235 muss auf 3 bis 5 % erhöht werden und der Gehalt von U-238 entsprechend vermindert werden. Zu diesem Zweck stehen drei aufwendige Verfahren der Isotopentrennung zur Verfügung: Gasdiffusionsverfahren, Schleuderverfahren (Gaszentrifugen) und Laser-Isotopentrennung. Dazu wird in einer „Konversionsanlage“ das Uran mit Fluor zu Uranhexafluorid (UF6) überführt.
Das Schleuderverfahren wird z. B. in der deutschen Anreicherungsanlage Gronau (Westfalen) angewendet: Es wird Uranhexafluorid durch kaskadisch hintereinander gereihte Gaszentrifugen geleitet, wobei der geringfügige Masseunterschied zwischen U-238 und U-235 für die Isotopentrennung genutzt wird (U-238 ist logischerweise um eine Spur schwerer als U-235). Geringe Mengen von U-238 werden abgeschieden, und der Gehalt von U-235 steigt. Das Uranhexafluorid wird dann in Urandioxid (UO2) umgewandelt. Dieses wird schließlich zu Tabletten gepresst, mit denen die Röhrchen der Brennelemente befüllt werden.
In der Anreicherungsanlage kann man auch bombenfähiges Uran („hoch angereichertes Uran“) herstellen, wobei der Gehalt an U-235 bei 80 % liegt.
Auslösung der Spaltung eines Atoms und die Folgen:
Ein freies Neutron kollidiert mit einem Atomkern von Uran-235 oder von Pu-239 und wird von diesem „eingefangen“. Der Atomkern gerät dadurch in Unruhe und zerplatzt mit großer Heftigkeit in zwei (oder sogar drei) ungleiche Teile. Entsprechend der Größe dieser Atomkern-Teile verteilen sich auch die Elektronen der Hülle. Es entstehen zwei (selten 3) neue Atome. Bei Zweiteilung eines Atoms von U-235 (OZ 92) könnten es ein Atom von Barium (OZ 56) und eines von Krypton (OZ 36) sein. 56 + 36 = 92. Es wäre aber auch möglich, dass ein Jod-Atom (OZ 53) und ein Yttrium-Atom (OZ 39) entstehen. Denn die Spaltung von Atomen geschieht willkürlich, sodass sich verschiedenste Spaltprodukte bilden können.
Diese neuen kleineren Atome nennt man „Spaltprodukte“. Jedes Spaltprodukt ist radioaktiv. Zugleich werden vom Atomkern bei der Spaltung 2 oder 3 Neutronen weggeschleudert, und ein Gamma-Quant wird emittiert.
Man bezeichnet die Atomspaltung allgemein als „Kernspaltung“, weil die Initiative zur Spaltung vom Atomkern ausgeht.
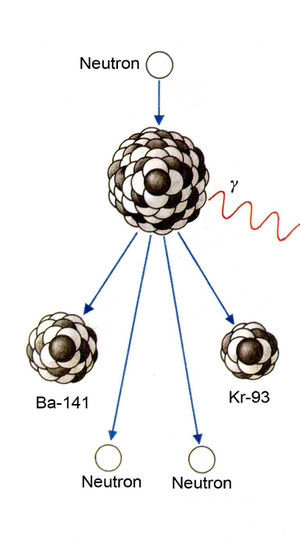
Spaltung eines U-235-Atomkerns: U-235 + 1N = U-236. Unruhe –> Spaltung –> Gamma-Quant und neue Teilchen als Resultat: Ba-141 + Kr-93 + 2N
Graphik aus „PC 8. Arbeitsbuch für Physik und Chemie für die 4. Klasse Hauptschule“, Rötzer Verlag, Eisenstadt 1978
Kettenreaktion:
Um nicht nur ein Atom von U-235 oder PU-239 zu spalten, sondern gleich viele Millionen Atome, nutzt man das Prinzip der „Kettenreaktion“. Das heißt, man bringt ein Atom dazu, dass es sich spaltet und überlässt es den weggeschleuderten Neutronen, weitere Atomkerne in Unruhe zu versetzen und zur Spaltung zu bringen. Damit eröffnet sich die Möglichkeit eines sich selbst erhaltenden fortschreitenden Spaltungsprozesses, allgemein als „Kettenreaktion“ bezeichnet.
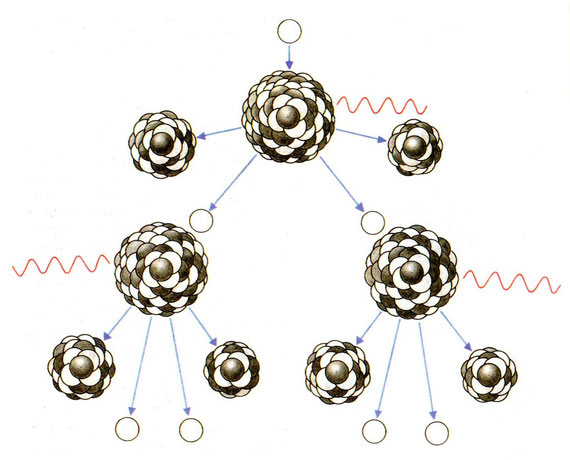
Graphische Darstellung der Kettenreaktion
Graphik aus „PC 8. Arbeitsbuch für Physik und Chemie für die 4. Klasse Hauptschule“, Rötzer Verlag, Eisenstadt 1978
Kettenreaktion in der Atombombe:
Wenn sich in einem Klumpen U-235 oder Pu-239 von einer bestimmten Masse eine Unzahl spaltbarer Atome in unmittelbarer Nachbarschaft befinden, dann genügt es, wenn nur der Kern eines einzigen Atoms mit einem freien Neutron kollidiert und zerplatzt, und schon nimmt die Zahl der sich spaltenden Atomkerne unkontrollierbar mit ungeheuerer Geschwindigkeit zu. Denn die bei der Spaltung des einen Atoms weggeschleuderten 2 oder 3 Neutronen treffen (unter der theoretischen Annahme 100%iger Treffsicherheit) weitere 2 bis 3 Atomkerne, die ihrerseits bei der Spaltung wieder je 2 bis 3 Neutronen wegschleudern, insgesamt also 4 bis 6 Neutronen. Diese spalten 4 bis 6 Atomkerne, wobei abermals 8 bis 12 Neutronen wegspringen. Usw. So kann in einem Klumpen U-235 oder Pu-239 innerhalb eines Bruchteils einer Sekunde der Großteil der Atome gespalten werden, wobei plötzlich eine unvorstellbare Energiemenge freigesetzt wird. Dies ist die Atombombenexplosion mit ihren verheerenden Folgen: Atomblitz (Hitzestrahlung, Gammastrahlung, Neutronenstrahlung), Druckwelle vom Explosionszentrum, darauffolgender Sturm in Richtung Explosionszentrum, „Atompilz“, radioaktiver Fallout (Niederschlag).
Voraussetzungen der explosionsartig fortschreitenden Kettenreaktion sind eine hohe Reinheit des spaltbaren Materials und eine bestimmte Mindestmasse, die man „kritische Masse“ nennt:
- Kritische Masse für reines U-235: 50 kg (nur theoretisch möglich, in der Praxis ist immer etwas U-238 dabei).
- Kritische Masse für reines Pu-239: 16 kg (auch nur theoretisch möglich, denn in der Praxis ist es immer mit Pu-240 und Pu-241 verunreinigt). Wenn durch einen Reflektor erreicht wird, dass Neutronen, die entweichen würden, reflektiert werden und somit zusätzlich für die Kernspaltung zur Verfügung stehen, genügen schon 10 kg Pu-239.
In einer kleineren Masse kann sich die Kettenreaktion nicht selber aufrecht erhalten. Man nennt sie „unterkritische Masse“. Eine größere Masse als die kritische Masse wird mit „überkritische Masse“ bezeichnet.
Zündung einer Atombombe:
Zwei oder mehrere Teile des spaltbaren Materials, die für sich alleine unterkritisch sind (die kritische Masse unterschreiten) und in sicherem Abstand voneinander angeordnet sind, werden mit Hilfe von herkömmlichem Sprengstoff so heftig aufeinander geschossen, dass die Wucht des Aufpralls die Stücke zusammenschweißt. In diesem Moment entsteht eine überkritische Masse, die durch initiale Neutronen, die von einer Neutronenquelle kommen, „gezündet“ wird (d. h. die Kettenreaktion eingeleitet wird).
Infos zur "friedlichen Nutzung" der Atomenergie
Infos zum Thema Radioaktivität
Infos über die Gefahren der AKW´s
-----------------------------------
F. d. I. v.: Heinrich Höbarth
 Umstieg auf erneuerbare Energiequellen als einziger Ausweg
Umstieg auf erneuerbare Energiequellen als einziger Ausweg