Kleine Atomkunde zum Thema „Cäsium“:
1) Atome und Isotope:
Atom = kleinstes, mit chemischen Methoden nicht weiter zerlegbares Teilchen eines chemischen Elements, das dessen chemische und physikalische Eigenschaften bestimmt.
Es gibt in der Natur 92 Atomarten (chemische Elemente): Wasserstoff, Helium, Lithium, Kohlenstoff, Stickstoff, Sauerstoff, Neon, Natrium, Magnesium, Aluminium, Schwefel, Chlor, Eisen, Kupfer usw.
Ein Atom besteht aus Atomkern und Elektronenhülle.
Atomkern ohne Elektronenhülle: ca. 10-12 cm Radius (0,000000000001 cm)
Atomkern mit Elektronenhülle: ca. 10-8 cm Radius (0,00000001 cm)
Der Atomkern enthält 99,9 % der Atommasse und baut sich aus zwei Arten von Teilchen (Nukliden) auf: aus Protonen („p“, positiv geladene Teilchen) und aus Neutronen („n“, die, wie der Name sagt, neutral sind, also ohne Ladung). Mit zunehmender Große der Atome steigt die Neutronenzahl stärker an als die der Protonen.
Das „größte“ natürliche Atom ist das Uranatom, dessen Kern aus 92 p und – je nach Uran-Isotop – aus 142, 143 bzw. 146 n gebildet wird.
Isotope sind Arten eines bestimmten chemischen Elements. Sie unterscheiden sich durch die Neutronenzahlen.
Die drei natürlichen Uran-Isotope sind:
- U-134 (92 p und 142 n) – im Natururan nur in Spuren enthalten.
- U-235 (92 p und 143 n) – ist spaltbar und wird daher in Atomkraftwerken verwendet, ist aber im Natururan nur zu 0,7 % enthalten und muss daher auf 3 bis 5 % angereichert werden.
- U-238 (92 p und 146 n) – mit 97 % der Hauptbestandteil des Natururans.
Alle drei Uran-Isotope sind radioaktiv (natürliche Radioaktivität) und sind als Alpha-Strahler besonders dann gefährlich, wenn sie sich im Körper einlagern, z. B. Uranstaub in der Lunge. Alpha-Strahlen sind weggeschleuderte Teilchen (Alpha-Teilchen), die zwar eine geringe Reichweite haben, aber viel zerstörerische Energie besitzen. Ein solches Teilchen besteht aus zwei Protonen und zwei Neutronen.
Die Brennelemente in den Atomkraftwerken enthalten 95 bis 97 % vom U-238 und 3 bis 5 % vom spaltbaren U-235. Die Brennelemente sind Bündel von langen Zirkonium-Röhrchen, in denen sich die Uranoxid-Tabletten befinden.
2) Chemische Eigenschaften von Cäsium:
Die chemischen Eigenschaften eines Stoffes werden durch die Elektronenhülle bestimmt (Chemie). Elektronen sind extrem kleine Teilchen, die negativ geladen sind. Sie heißen daher auch „Negatronen“. Die Zahl der Protonen und Elektronen ist im Atom gleich groß und bestimmt daher als Ordnungszahl (OZ) den Platz in der Tabelle der chemischen Elemente.
Das Cäsium (Symbol: „Cs“) ist ein goldgelb schimmerndes, sehr weiches und sehr leichtes Alkalimetall, das in der Natur eher selten vorkommt. Die Oberfläche eines Cäsium-Stückes oxidiert rasch an der Luft. Mit Wasser reagiert Cäsium heftig. Es kommt daher in der Natur nur in Verbindungen vor (Mineralien). Die Elektronenhülle des Cäsiumatoms besteht aus 55 Elektronen. Dieser Zahl entspricht die Menge der Protonen im Kern des Cäsiumatoms: 55 Protonen. In der Tabelle der chemischen Elemente befindet sich daher das Cäsiumatom an 55. Stelle (OZ 55).
Das natürliche Cäsium ist das Cs-133, das nicht radioaktiv ist. Cs-133 heißt, dass der Kern des Cs-Atoms aus 133 Teilchen besteht, nämlich aus 55 Protonen und aus 78 Neutronen. Cs-Mineralien werden wie andere Mineralien mit der Nahrung aufgenommen und wegen der Ähnlichkeit des Cäsiums mit dem Kalium im Magen-Darm-Trakt resorbiert und – analog zum Kalium – vorwiegend im Muskelgewebe gespeichert. Die biologische Halbwertszeit, mit der Cäsium vom menschlichen Körper wieder ausgeschieden wird, ist abhängig vom Alter und Geschlecht und beträgt im Schnitt ca. 100 Tage. Da unser Körper das radioaktive Cäsium nicht vom natürlichen unterscheiden kann, nimmt er auch das radioaktive auf.
3) Wie entsteht Cäsium in Atomkraftwerken?
In Atomreaktoren werden die Uran-235-Atome, die in den Brennelementen enthalten sind, gespalten, wobei Wärme entsteht. Die Spaltung beginnt, sobald es durch „Neutronenbeschuss“ gelingt, Uran-235-Kerne zu treffen. Absorbiert ein Atomkern ein Neutron, so gerät er in Unruhe und spaltet sich. Dabei nimmt jedes Spaltprodukt die entsprechenden Elektronen mit sich, und es entstehen neue Atome – unter anderem auch Cäsium-Atome.
Cäsium ist demnach ein Spaltprodukt aus der Atomspaltung von U-235.
Der sich spaltende Atomkern emittiert Energie in Form eines Gamma-Quants und schleudert Neutronen weg, von denen einige auch weitere Atomkerne treffen und auch diese zur Spaltung anregen. So setzt sich die „Kettenreaktion“ fort (in Atomkraftwerken langsam fortschreitend, in Atombomben wegen des hohen Gehaltes von U-235 im Bruchteil einer Sekunde).
Da die Atomkerne die Ursache für die Atomspaltung und für die Radioaktivität sind, befasst sich damit die „Kernphysik“. Man spricht von „Kernforschung“, „Kernspaltung“, „Kernkraftwerken“, „Kernwaffen“ und „Kernenergie“ („Nuklearenergie“, nucleus (lat.) = Kern).
4) Beispiele von Spaltprodukten:
Cer und Selen (58 p + 34 p = 92 p)
Lanthan und Brom (57 p + 35 p = 92 p)
Barium und Krypton (56 p + 36 p = 92 p)
Cäsium und Rubidium (55 p + 37 p = 92 p)
Xenon und Strontium (54 p + 38 p = 92 p)
Jod und Yttrium (53 p + 39 p = 92 p)
Tellur und Zirconium (52 p + 40 p = 92 p)
Antimon und Niobium (51 p + 41 p = 92 p)
Cadmium und Ruthenium (48 p + 44 p = 92 p)
Usw.
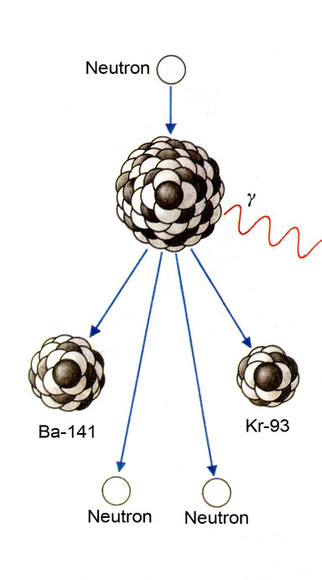
Der Atomkern eines U-235-Atoms wird von einem Neutron getroffen und spaltet sich. Es entstehen z. B. ein Atomkern von Krypton und einer von Barium.
Neben den Spaltprodukten entstehen im Reaktorkern durch die intensive Neutronenstrahlung auch „Transurane“, also künstliche chemische Elemente jenseits von Uran, wie z. B. das hochgiftige Plutonium-Isotop Pu-239 (Alpha-Strahler). Außerdem bildet sich im Reaktorkern das radioaktive Wasserstoff-Isotop Tritium.
5) Was ist Radioaktivität:
Die Reste aus der Atomspaltung sind gespaltene Atome („Spaltprodukte“), außerdem instabile Transurane (Plutonium…), das Resturan (U-238 und etwas U-235) und das Tritium – also der Atommüll. Sie sind in den „abgebrannten Brennelementen“ eingeschlossen, und diese Müll-Brennelemente müssen ständig gekühlt werden.
Einfacher wäre es, wenn bei der Atomspaltung nur zwei Stoffe (zwei Spaltprodukte) entstünden und diese in stabilem Zustand anfallen würden, also nicht radioaktiv wären. Aber leider entsteht bei der Atomspaltung eine Vielzahl von Stoffen, wobei noch dazu jeder Stoff in Form mehrerer Isotope in Erscheinung tritt und außerdem jedes Isotop instabil ist, also radioaktiv. Dazu kommen die Resturan- und Transurane-Problematik und das Tritium-Problem.
Jedes Atom eines jeden instabilen Isotops wandelt sich zu irgendeinem Zeitpunkt spontan in ein Nachbarisotop um, schleudert dabei ein Teilchen weg (Alpha- oder Beta-Strahl) und emittiert einen Gamma-Quant (Gamma-Strahl). Beta-Strahlen (eigentlich Beta-Teilchen) sind weniger energiereich als Alpha-Strahlen, dafür reichen sie aber weiter. Gamma-Strahlen können nur durch dicke Betonbarrieren oder durch Bleiplatten aufgehalten werden.
Manche Isotope verwandeln sich sehr schnell, manche langsamer, manche sehr langsam. Die Zeit, in der sich die Hälfte verwandelt, nennt man Halbwertszeit (HZ).
6) Viele Cäsium-Isotope, zwei besonders gefährlich:
In Atomkraftwerken entstehenden 34 Cs-Isotope, die alle instabil sind. Die meisten Cs-Isotope sind extrem „kurzlebig“, das heißt, jedes Atom wandelt sich („zerfällt“) innerhalb von Sekunden oder Minuten unter Abstoßung eines Elektrons (= Negatrons = Beta-Strahl) und eines Gamma-Strahls in ein anderes Isotop um. Für Mensch und Umwelt am gefährlichsten sind aber die „langlebigen“ Cs-Isotope Cs-134 (HZ 2 Jahre) und Cs-137 (HZ 30 Jahre).
Die Atome von Cs-134 wandeln sich in das stabile Barium 134 um, die Atome von Cs-137 in das stabile Barium-137. Barium hat in der Elemente-Tabelle die OZ 56.
Darstellung des Beta-Zerfalls: Ein Neutron im Kern des instabilen Cs-137-Atoms zerfällt in ein Elektron (Negatron) und ein Proton. Das Elektron wird als Beta-Strahl abgestoßen. Resultat: ein Neutron weniger, ein Proton mehr. Das zusätzliche Proton führt zur Vergrößerung der Protonenzahl von 55 auf 56, also zum chemischen Element Barium.
Cäsium lagert sich – wie oben dargestellt – im menschlichen und tierischen Körper vorwiegend in den Muskeln ein. So auch die Isotope Cs-134 und Cs-137, die dort ihre Zellen zerstörende und krebserregende Wirkung entfalten. Da das Cäsium in Atomkraftwerken aus Uranoxid entsteht, fällt es in Form von Cäsiumoxid an. Es reagiert mit dem Kühlwasser, das den zerstörten Reaktorkern umspült, und wird von diesem Wasser rasch aufgelöst (basische Lösung, Lauge).
7) Radioaktivität ist durch nichts beeinflussbar:
Die Umwandlung („Atomzerfall“) von instabilen Atomen führt zu Erwärmung („Restzerfallswärme“, „Nachzerfallswärme“). Diese Selbsterwärmung findet auch dann statt, wenn die Brennelemente bereits zerstört sind und der Reaktorkern auf Grund der enormen Hitze geschmolzen ist („Kernschmelze“). Daraus ergibt sich der Zwang zur permanenten Kühlung, weil sonst der Reaktorkern den Reaktorsockel durchschmilzt, sich in den Boden hineinfrisst und das Grundwasser auf lange Zeit kontaminiert bzw. zu Knallgasbildung führt und Knallgasexplosionen verursacht. Dass ein Mensch kontrollieren könnte, wie weit die Kernschmelze in die Tiefe gedrungen ist, ist wegen der hohen Radioaktivität nicht möglich, abgesehen davon, dass der Zutritt auf Grund der zerstörten Reaktorkomponenten kaum möglich ist.
Dieser Selbsterhitzungsvorgang nimmt erst in dem Tempo ab, in dem die Umwandlung von instabilen Atomen in stabile fortgeschritten ist, was von den Halbwertszeiten der verschiedenen radioaktiven Isotope abhängt.
Das Schlimmste daran ist, dass sich dieser Vorgang durch nichts beeinflussen lässt und unbeirrbar fortschreitet. Das ist der Rattenschwanz der Atomtechnik.
Wenn man es vor dem Atomzeitalter mit toxischen Stoffen zu tun hatte, so wusste man aus Erfahrung, dass Gifte neutralisierbar sind. Denn die Chemie ist eine Angelegenheit der Elektronenhülle. Aber Radioaktivität ist eine Eigenschaft des Atomkerns und deshalb durch Chemikalien nicht neutralisierbar. Es gibt nichts, womit man Radioaktivität neutralisieren könnte.
8) Wie kann man erkennen, dass die Strahlung von Cäsium stammt?
An den Gamma-Quanten kann man erkennen, dass sie von einem Cäsium-Zerfall kommen. Denn diese Gamma-Strahlen, die von Cs-137 oder von Cs-134 ausgehen, zeigen ganz bestimmte Linienspektren, die durch die Gamma-Spektroskopie sichtbar gemacht werden können. Jedes Isotop eines jeden chemischen Elements zeigt bei der Gamma-Spektroskopie eine andere Charakteristik. So kann man erkennen, von welchem instabilen Isotop die Strahlung stammt.
9) Ein weiteres gefährliches Spaltprodukt aus der Atomtechnik ist das Strontium-90:
Viele chemische Eigenschaften vom Erdalkalimetall Strontium („Sr“, OZ 38) sind denen vom Alkalimetall Cäsium ähnlich. Die natürlichen, nicht radioaktiven Sr-Isotope sind Sr-84, Sr-86, Sr-87 und Sr-88. Daneben gibt es 19 künstliche, also radioaktive Sr-Isotope. Mit Ausnahme von Sr-90 sind sie alle sehr kurzlebig. Sr-90 hat eine HZ von 28,5 Jahren, ist als Sr-Oxid wie Cs-Oxid leicht wasserlöslich (Lauge) und lagert sich wegen seiner chemischen Ähnlichkeit mit Calcium in den Knochen ein. Dort schädigt es die blutbildenden Zellen. Biologen nennen es einen „Knochenkiller“.
10) Offensichtlich ist das „Experiment Kernenergie“ gescheitert. Warum gibt es dennoch nach wie vor Anhänger der Kernenergie?
Dass es trotz Tschernobyl und Fukushima Anhänger der Atomenergie gibt, dass es Bauern gibt, die weiterhin umstrittene Nervengifte als Pflanzenschutzmittel verwenden wollen und dass es immer noch Ökonomen gibt, die meinen, der Markt werde alle Probleme lösen, das hat vor allem eine Ursache: Man tut sich schwer, von Gewohnten und Eingefahrenem abzulassen.
Dazu gesellt sich ein gefährliches Quartett: Profit- und Machtinteressen von Konzernen, Lobbyisten und Medien, Erfolgszwang bei den Politikern, Borniertheit, Karrieresucht und/oder Naivität von Wissenschaftern und Unwissenheit bei Politikern, Medien und Bevölkerung.
 Umstieg auf erneuerbare Energiequellen als einziger Ausweg
Umstieg auf erneuerbare Energiequellen als einziger Ausweg